FISIOPATOLOGÍA PULPAR (Canalda 4a.ed.,
La pulpa y el tejido periapical reaccionan ante los componentes bacterianos como cualquier tejido conectivo del organismo. El grado y la extensión de la lesión hística variarán en función de los factores de virulencia de las bacterias presentes y de los mecanismos defensivos del huésped.
Inflamación pulpar
La pulpa presenta unas características que la hacen fácilmente vulnerable a la inflamación: el tejido pulpar está contenido entre las paredes rígidas del conducto radicular, lo que determina una capacidad limitada de la expansión del edema, y su circulación es terminal, lo que impide su revascularización.
| |
|
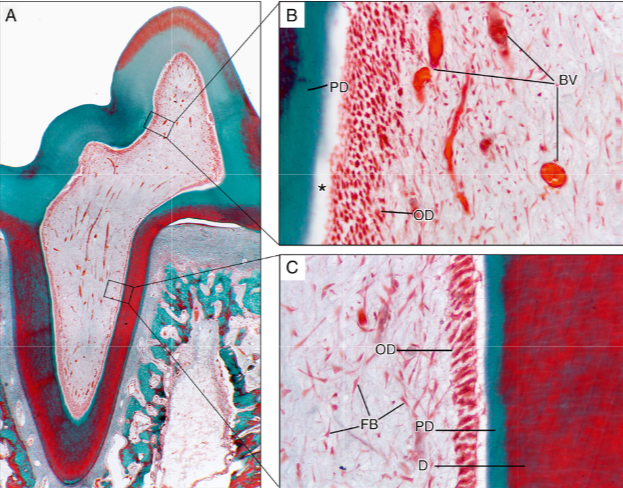 |
Sección histológica de (A) un molar de rata mostrando la porción pulpar coronal (B) y radicular (C) con mayor aumento.
BV, vasos sanguíneos
D, dentina;
FB, fibroblastos;
OD, odontoblastos en capa odontoblástica
PD, predentina.
Un arefacto (∗) separando la predentina de la capa odontoblástica |
Si los irritantes que llegan a la pulpa tienen escasa intensidad, se estimula la formación de dentina por parte de los odontoblastos, por lo que se denomina dentina reactiva. Si la agresión pulpar tiene mayor intensidad, hay destrucción de los odontoblastos. Si se instaura un tratamiento adecuado, la inflamación pulpar superficial puede remitir, diferenciándose nuevos odontoblastos o neoodontoblastos capaces de elaborar dentina reparativa o neodentina. Si no se efectúa un tratamiento o si la agresión es de intensidad elevada, la inflamación se extiende.
Inflamación aguda
La llegada de componentes bacterianos a través de los túbulos dentinarios produce diversos cambios en el tejido pulpar. Tras una breve vasoconstricción, provocada por la liberación de catecolaminas (dopamina, adrenalina, noradrenalina) por parte de las fibras simpáticas adrenérgicas, se observa una dilatación vascular, con incremento del flujo sanguíneo, modulada por mediadores plasmáticos y celulares. Las células endoteliales se retraen y los capilares se tornan más permeables, permitiendo un trasudado plasmático hacia el tejido intersticial. La salida de proteínas sanguíneas hacia el tejido aumenta la presión osmótica de este, con lo que se incrementa la salida de plasma y su acumulación, es decir, se forma edema. Se inicia la inflamación serosa.
| |
|
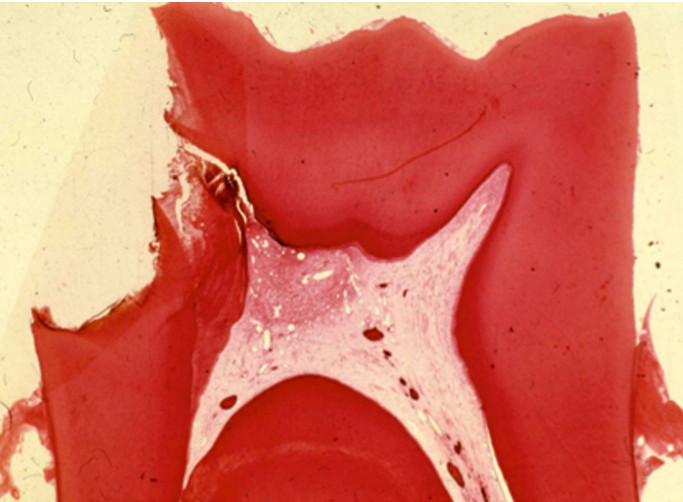 |
Reacción inflamatoria aguda conteniendo muchos leucocitos polimorfonucleares en el sitio de una exposición pulpar cariosa. El resto de la pulpa coronal está casi libre de células inflamatorias. |
Al mismo tiempo, se produce una marginación de los leucocitos polimorfonucleares hacia la periferia de los vasos, adhiriéndose a las células endoteliales y migrando hacia el tejido, lo que se conoce como diapédesis, atraídos por quimiotaxis, es decir, por la presencia de moléculas C5a y C3a. Los neutrófilos son células fagocíticas. Su vida media es corta, ya que resisten mal los descensos del pH, y no pueden vivir por debajo de 6,5; cuando perecen, se liberan enzimas proteolíticas contenidas en sus lisosomas, las cuales destruyen el tejido. El resultado es la formación de pus, constituido por restos hísticos, bacterias y diversos residuos. Se inicia la inflamación purulenta o supurada. En la destrucción hística colaboran distintas enzimas y componentes de las bacterias (colagenasas, proteasas, LPS), que actúan de modo inespecífico o como determinante antigénico. Las metaloproteinasas son un conjunto de enzimas capaces de destruir los componentes extracelulares hísticos, formados básicamente por colágeno tipo I y III. Se subdividen en colagenasas, gelatinasas, estromelisinas y metaloproteinasas tipo membrana. Se ha encontrado colagenasa y gelatinasas en el líquido de los quistes radiculares, así como en el tejido pulpar inflamado; son secretadas por leucocitos polimorfonucleares, macrófagos y plasmocitos, y su síntesis está modulada por la IL-1 y el TNF-α
Inflamación crónica
Aparece de modo precoz, ya que, junto con la liberación de mediadores que estimulan la destrucción del tejido, se liberan mediadores que estimulan la reparación. Con ello se establece la inflamación crónica, que coexiste con zonas de inflamación aguda.
En ella desempeñan un papel primordial las células mononucleares que resisten un pH bajo: linfocitos, células plasmáticas y macrófagos con función fagocítica. En la periferia de la zona inflamada se inicia la proliferación de los fibroblastos, liberándose numerosos mediadores que interaccionan entre sí.
En la zona de la pulpa donde llegan los componentes bacterianos se forma un microabsceso, mientras que a su alrededor se va instaurando la inflamación crónica. El tejido pulpar se va destruyendo a mayor o menor velocidad mediante fenómenos de necrosis por coagulación y por licuefacción.
| |
|
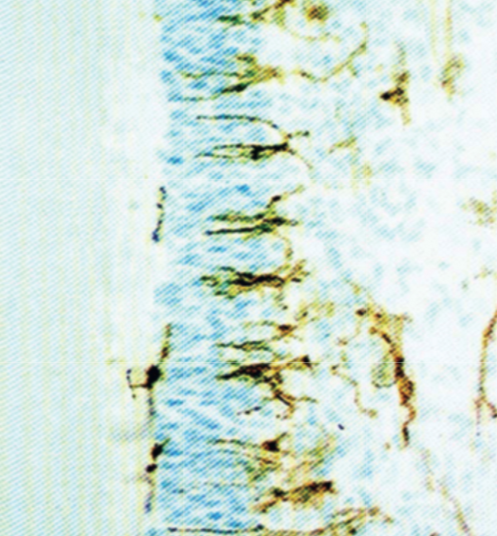 |
Dental caries stimulates the accumulation of pulpal dendritic cells in and around the odontoblastic layer. |
La existencia de una vía de escape para los exudados puede retardar estos fenómenos, pero a la larga, una pulpitis localizada, inicialmente reversible mediante tratamiento, se extiende y se transforma en irreversible. La inflamación pulpar constituye la primera barrera de defensa del organismo ante la invasión bacteriana. La necrosis hística es una compañera inseparable de la inflamación pulpar. En sentido centrípeto y coronoapical, la necrosis progresa hasta ser total.
La mayoría de las pulpitis evolucionan de modo asintomático, mediante la propagación de la inflamación crónica a través de toda la pulpa, la cual es seguida de la necrosis del tejido. La ausencia de síntomas es posible que se deba a la liberación, por parte de las fibras nerviosas pulpares, de neuromoduladores. Tood y cols. hallaron en pulpas inflamadas concentraciones muy elevadas de ácido γ-aminobutírico (GABA), un neuropéptido inhibidor de la transmisión nerviosa en el sistema nervioso central y de las fibras A-δ y C. Si la vía de escape de los exudados, como sucede en una caries, se cierra, la pulpitis asintomática puede agudizarse y evidenciarse su existencia.
En la pulpa inflamada se localizan diversas células inmunocompetentes: células dendríticas (DC), que presentan el antígeno como los macrófagos, junto a la capa odontoblástica, macrófagos, leucocitos polimorfonucleares, linfocitos T colaboradores y citotóxicos/supresores, linfocitos B y células plasmáticas, todas ellas responsables de la respuesta específica, y células agresoras o asesinas naturales (NK, natural killer), que intervienen en la respuesta inespecífica, lo mismo que los polimorfonucleares y los monocitos. Los valores de inmunoglobulinas (Ig) también se hallan elevados, especialmente las IgG y algo menos las IgA. En pulpas inflamadas se han identificado anticuerpos, ausentes en pulpas sanas, y anticuerpos capaces de interaccionar con las bacterias aisladas de la caries. También se ha demostrado la formación de complejos inmunes, con fijación del complemento. A pesar de la presencia de todos estos elementos, si la inflamación no se resuelve en sus fases iniciales mediante la instauración de un tratamiento adecuado, la desestructuración del tejido pulpar avanzará hasta su total destrucción.
Inflamación periapical
La inflamación periapical se inicia antes de que se complete la necrosis pulpar, y puede haber lisis ósea en el periápice, visible en las radiografías, sin necesidad de que el tejido pulpar en la zona final del conducto esté destruido. Además, las fibras nerviosas son las últimas estructuras que se destruyen, lo que explica la aparición de dolor al instrumentar dicha zona en dientes con periodontitis.
La inflamación del periápice constituye la segunda barrera defensiva del organismo ante la llegada de bacterias, con la intención de mantenerlas confinadas en el interior del conducto. Se inicia con la aparición de un infiltrado inflamatorio de tipo crónico en la proximidad del orificio apical, observándose osteoclastos que inician la reabsorción ósea estimulados por diversos mediadores: IL-1, TNF, prostaglandinas (PGE2). Una vez que se reabsorbe el hueso, como mecanismo defensivo, se produce la formación de tejido granulomatoso, consecuencia de la proliferación de los fibroblastos de la periferia, por lo que se segrega colágeno y se forma una neovascularización regulada por distintos mediadores.
La formación de tejido granulomatoso es una consecuencia de la imposibilidad del sistema defensivo celular para eliminar totalmente las bacterias y los componentes antigénicos que siguen llegando a partir del conducto radicular. Los linfocitos siguen presentes, segregando diversas citocinas, con lo que se estimula la formación de tejido granulomatoso.
En las lesiones granulomatosas las células inflamatorias constituyen la mitad de las células presentes. Aunque se han identificado neutrófilos polimorfonucleares, las células predominantes son las mononucleares, los linfocitos y los macrófagos. Es frecuente la presencia de células multinucleadas gigantes, derivadas de los macrófagos y con funciones secretoras. Matsuo y cols. hallaron en lesiones granulomatosas un 50% de plasmocitos, entre los que predominaban los productores de IgG (85%), seguidos de los secretores de IgA (15%) e indicios de los responsables de la IgM; un 40% de linfocitos T, y un 10% de monocitos/macrófagos. Para Stashenko y cols., los linfocitos son las células mayoritarias en las lesiones granulomatosas, y predominan los linfocitos T colaboradores en las fases agudas y los T supresores en las crónicas.
Los linfocitos T citotóxicos, similares a las células NK, también se han identificado en las lesiones periapicales. Cuando una lesión periapical recibe tratamiento endodóncico, disminuye la proporción de linfocitos B y T y, entre estos, aumenta la proporción de T supresores y disminuye la de colaboradores.
Los valores de Ig se encuentran elevados en las lesiones periapicales. Aunque existen pequeñas discrepancias entre las distintas investigaciones, la proporción de plasmocitos productores es la siguiente: IgG (72%), IgA (14%), IgE (10%) e IgM (4%). Los antígenos procedentes de los conductos radiculares inducen la respuesta inmune específica, secretándose Ig.
Se ha demostrado la formación de complejos inmunes, capaces de inducir la reabsorción ósea, en las lesiones periapicales, lo que indica la existencia de reacciones de hipersensibilidad mediada por complejos (tipo III) en las lesiones periapicales. También se han identificado mastocitos con IgE en su superficie, lo que hace pensar en reacciones de hipersensibilidad inmediata (tipo I) que podrían estar presentes en el inicio de las lesiones o en su reagudización. La proliferación de linfocitos T en las lesiones periapicales crónicas justifica la existencia de reacciones de hipersensibilidad celular (tipo IV). Las reacciones de hipersensibilidad, expresión de una respuesta inmune específica exagerada o inadecuada, causan inflamación y daño a los tejidos.
ir a INICIO |

